
沈阳

环球教育代码TS000173
欢迎来到环球教育官方网站,来环球,去全球,名师高徒,高分留学!
来源:环球教育
小编:长安 251CIE考试党们有福利了,环球教育黄红端老师今天开始给大家归纳下CIE考试必考考点过渡态金属的那些事,想要出乎不意考到满意成绩的,就注意看招接招啊!
过渡态金属的考点包含一些定义的默写,比如transition metals、complex、ligand、degenerate,这些不用我多说,大家自己去查找概念记住吧。首先我们先来看看过渡态金属和离子的电子构象的写法。比如:
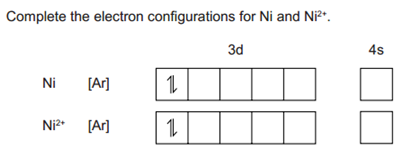
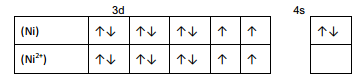
过渡态金属构象有点特殊的就是在排布电子时,面对3d和4s的区别,我们需要优先排布4s,剩余的电子再安排在3d轨道上,这是因为4s轨道的的能量比3d的要低,同理失去电子时也应该在原子电子构象的基础上,优先失去4s上的电子,切不可直接根据离子电子数排布。所以本题的电子构象就是:
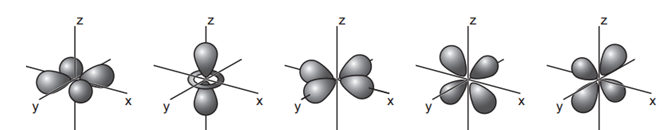
接下来我们再看看d轨道的图形,包含5个轨道,形状稍微有点不同,如下,其中第二个和三个轨道的能量稍高。
为什么要了解电子构象以及d轨道呢?因为这和过渡态金属离子丰富的颜色有很大关系,我们需要解释显色原理。下面我们以铜离子为啥呢么是蓝色为列加以说明。刚才我们说到5个d轨道能量是有差别的,这个就叫做orbital splitting,我们可以看到如图5个d轨道按能量的不同分成了两组,这个能量差就是△E。
溶液在光照条件下,位于lower energy level的电子吸收了足够的能量,刚好满足△E的大小,所以电子发生跃迁(promoted),跑到higher energy level的empty orbital上变为excited electron,根据光的波长与能量的关系△E = hv,空气中的白光因为被吸收了对应频率的光波,因此剩余部分显示的颜色就是被吸收光波的互补色。这也就是说铜离子容易之所以显蓝色,其实是因为蓝色的互补颜色被容易所吸收而导致的。
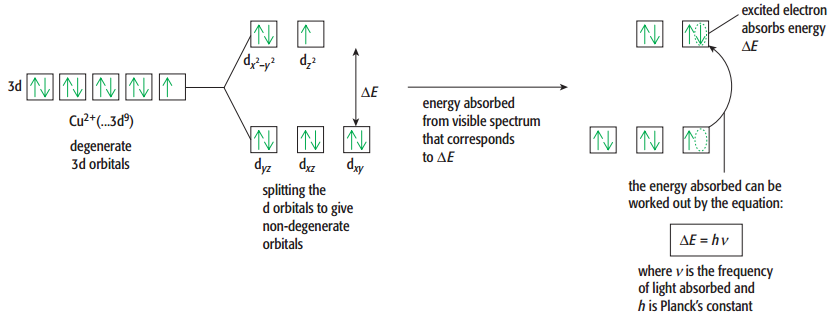
用英文答题也非常好理解,就是 As the electrons move from lower to upper level,the solution absorbs light, so the complementary color os seen。这点也侧面说明了为什么过渡态金属的的定义中突出的是incomplete orbital,因为有empty orbital,这样电子才能可以发生跃迁,才能吸收光波,才会显出丰富的颜色。这也是过渡态金属的化学特性之一-colorful。
那么为什么每种过渡态金属离子的显色如此不同呢?即使是同一种离子它的颜色也是有区别的。那么这个就和本身过渡态金属的种类、配体类型、配体个数以及离子的化合价很大关系,下次我们接着聊配合物的反应类型以及如何把各类反应对号入座。