
沈阳

400-999-9090
雅思考试官方认证合作伙伴
环球教育代码TS000173
环球教育代码TS000173
欢迎来到环球教育官方网站,来环球,去全球,名师高徒,高分留学!
来源:环球教育
小编:长安 128 化学平衡常数equilibrium constants,包括Kc和Kp两种,分别用于在溶液中反应和气体状态下反应这两种情况。环球教育黄红端老师告诉大家Kc的计算方法。

Kp的计算方程式雷同,只是需要注意把所有的浓度转化为分压partial pressure。什么叫分压呢?在一个密闭的容器中,每一种气体单独对容器壁所造成的压强,压强和体积或者摩尔数成正比。所以某一种成分的分压等于Ptotal乘以该组分的摩尔分数。

以一道真题为例看看如何正确计算Kp。
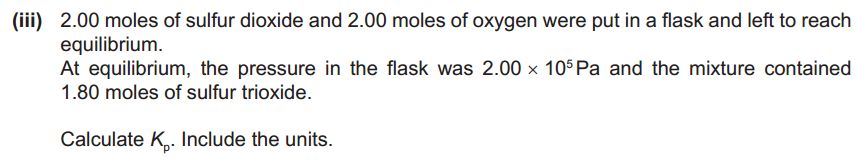
我们从题目中先判断出所有成分在平衡时的物质的量是否已知,需不需要求?题中left可以看出2mole只是二氧化硫和氧气反应之前的物质的量,所以需要求。怎么求呢,步骤一定要规范,这样可以避免丢分。首先写出方程式:
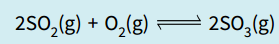
我们已经把平衡时每种气体的摩尔数求出来了,现在可以求partial pressure。


最后可以得出Kp。看似简单。很多学生容易跳进两个陷阱,一是直接认为条件已知的就是平衡时的物质的量,而是分压的计算方法没掌握好,直接用摩尔数相比。